
分担研究者:東北大学 加藤幸成(代表:量⼦科学技術研究開発機構 東 達也)
令和4年度〜令和6年度
課題名:悪性中皮腫を対象としたポドプラニン標的放射免疫療法実用化に向けた非臨床試験
悪性中皮腫の新規治療法として、ポドプラニンを認識する抗体を放射性標識し、イメージング、β線治療、α線治療を可能とするポドプラニン標的放射免疫療法の実用化に向けた非臨床試験を実施する。具体的には、抗ポドプラニン抗体NZ-16のGMP製造、GLP安全性試験、放射性薬剤GMP製造法確立、薬物動態試験、治験プロトコル策定等を実施する。
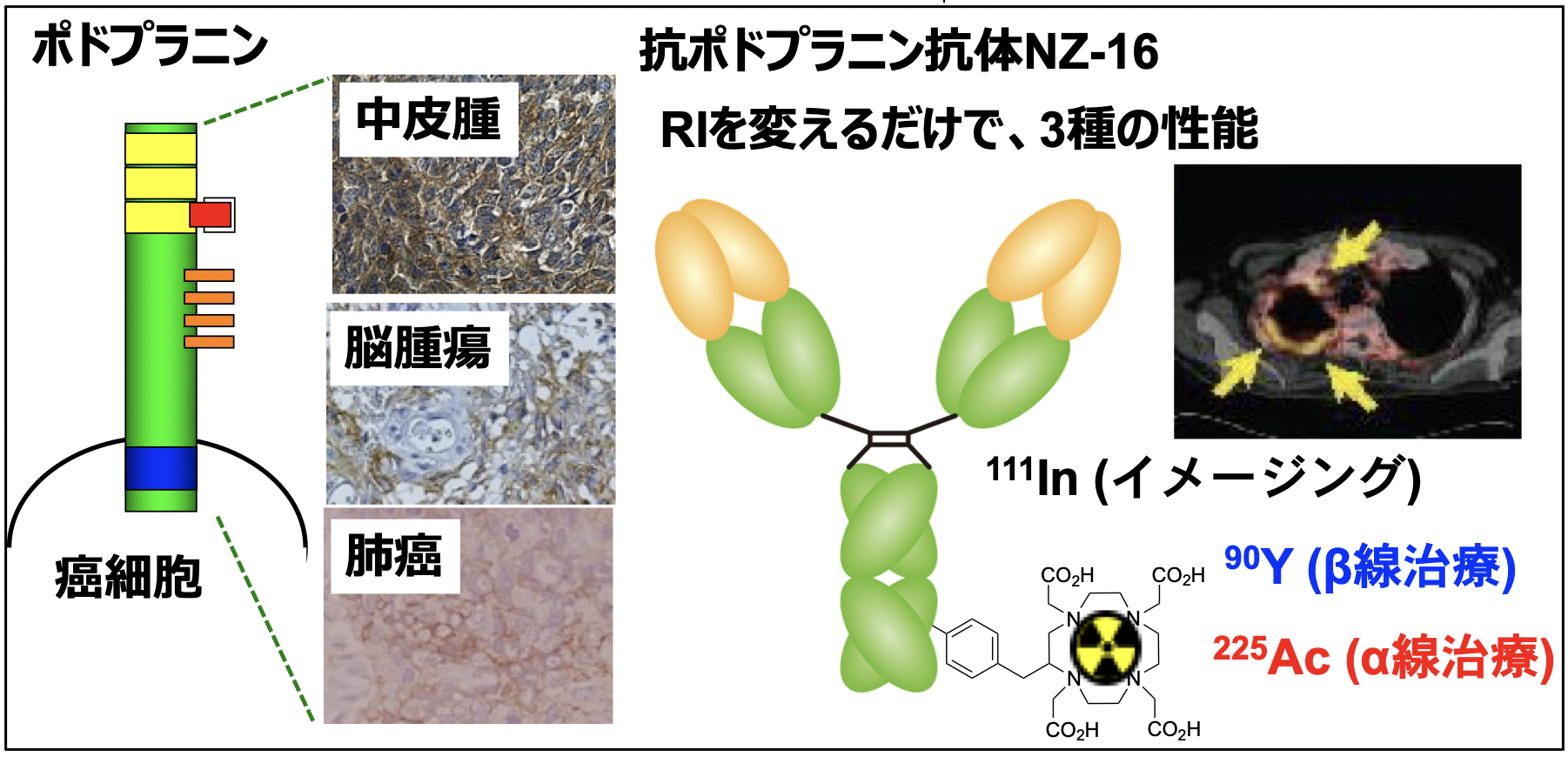
ポドプラニンは悪性中皮腫、脳腫瘍など様々ながんで高発現しており、悪性度の高い肉腫型でも高発現している。研究分担者の加藤は、腫瘍に発現しているポドプラニンは認識するが、正常組織に発現しているポドプラニンは認識しない腫瘍特異抗体NZ-1を開発した。この抗体を改変したNZ-12は、サルでの予備的な単回投与毒性試験で毒性を示さず、サルでのイメージングでも正常組織への集積は低くかった。本課題ではさらにFcを改良し安定性が増したNZ-16の実用化を目指す。この抗体が、世界で唯一のポドプラニン標的放射免疫療法として臨床利用できる抗体である。
アカデミアにとって、バイオ医薬品の治験実施のハードルは非常に高い。しかし、放射免疫療法であれば、投与する物質量が微量(最大0.075mg/kg)であり、イメージングにより患者ごとに適切な投与量を決定できることから、アカデミア主体であっても治験の実現は可能である。従来のβ線治療核種に加え、末期の転移性前立腺がん患者でも完全奏効を達成したα線治療核種225Acが臨床利用できるようになり、核医学治療は難治性固形がんにも有効な治療法となった。研究代表者の東は、NZ-16でのβ線放出90Y標及びα線放出225Ac識体で高い治療効果を実証した。さらに、AMED CiCLEで、225Acの国内供給のための製造技術開発にも成功した。非臨床POCを取得済みで、α線治療の技術基盤もあることから、実現性は高い。
中皮腫は、日本での罹患率は高くないが、中国を始めとする多くの途上国では患者の増加が見込まれている。また、脳腫瘍等への適応拡大の潜在性も有している。臨床POCが得られれば、企業に導出できる。
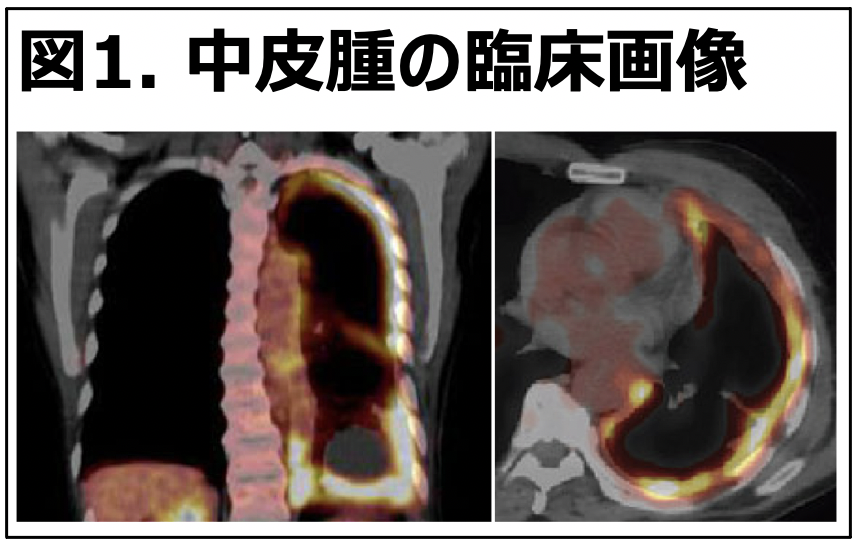
悪性中皮腫は、2005年のクボタショックを契機に大きな社会問題となった。アスベスト使用制限が遅れたことが原因で、患者の救済に別途法律が制定されおり、その救済に国も積極的に関与している。悪性中皮腫、特に肉腫型には有効な治療法がなく、予後不良である。中皮腫の平均生存期間は9~12ヶ月であり、世界で年間4万人以上が死亡している。悪性胸膜中皮腫の約7割は進行がんであり、胸膜に沿ってびまん性に進展しており(図1)、一般的な放射線治療は困難である。外科手術も侵襲性が非常に高いため、高齢者が多い中皮腫には適応が難しい。現在使用されている化学療法、ペメドレキセド+シスプラチン併用化学療法の奏効率44%、延命効果は3ヶ月である。免疫チェックポイント阻害剤のPhase3試験の結果では、奏効率40%、延命効果7ヶ月であった。まだ、治療効果が高く侵襲性の低い新しい治療法の開発が強く求められている状況に変わりはない。非密封放射性同位元素で標識した抗体を用いる放射免疫療法は、放射線治療の一種の核医学治療であり、患者が自覚する有害事象がほとんど生じず、高齢者にも適した治療法である。日本での中皮腫の罹患率は900人/年の希少がんであり、企業主体での開発は望めないため、アカデミア主体での開発が必須である。
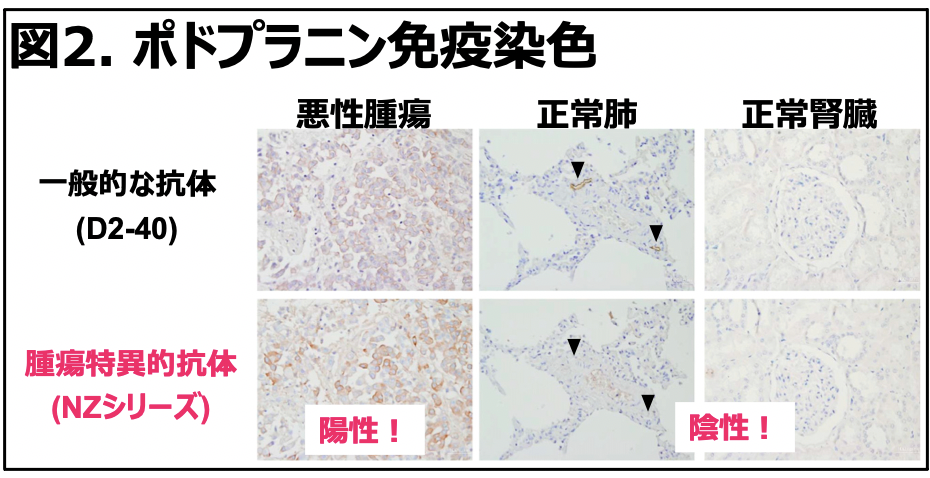
転移など悪性度に関わっているポドプラニンは、悪性中皮腫にも高率で発現しており、悪性度の高い肉腫型でも発現率が高いため、有望な治療標的分子である。しかし、正常組織にも発現しており、副作用が懸念されていた。しかし、研究分担者の加藤は、正常組織に発現しているポドプラニンは認識せず、腫瘍に発現しているポドプラニンだけを認識する腫瘍特異的抗ポドプラニン抗体NZ-1の開発に成功した(図2;Kato, BBRC, 2006)。この抗体のエピトープ付近には、がん特異的糖鎖付加部位が複数存在する。例えば、Thr52, Thr55, Ser56などである。このがん特異的糖鎖付加部位を直接認識するわけではないが、この近辺の38-51 aaを認識しているため、がん特異的糖鎖がThr52, Thr55, Ser56に付加した場合に、38-51 aaの立体構造が変化すると考えられている。したがって、がん細胞のPDPNと正常細胞のPDPNでは38-51 aaの立体構造が異なり、これがNZ-16抗体のがん特異性のメカニズムだと考えられる。この抗体の腫瘍での陽性率は93%と従来の抗体と同等以上であり、がん治療に理想的な抗体と言える。ラット抗体であるNZ-1の免疫原性を下げるために、Fc等をヒト化した多種類の抗体を開発し、その中のNZ-12は安定性が高く、β線放出核種90Y標識NZ-12が中皮腫モデルマウスで高い治療効果を示した(Sudo, Cancer Sci, 2019)。予備的ではあるが、サル安全性試験では毒性は観察されず、サルでのイメージングでも正常臓器への高い集積はないことが示された。さらに抗体の改良を重ね、30以上の改変体の中で、NZ-16の親和性・安定性が最も高かった。90Y及び225Ac標識NZ-16はNZ-12よりも高い治療効果を示した(Sudo, Cells, 2021)。
アカデミアにとって、バイオ医薬品の治験実施のハードルは非常に高い。しかし、放射免疫療法であれば、投与する物質量が微量(最大0.075mg/kg)のため製造コストが低い。また、イメージングにより患者ごとに適切な投与量を決定できるため、アカデミア主体であっても治験実施が可能である。従来のβ線治療核種では難治性固形がんの奏効率は高くはないが、α線治療核種225Acは、標識PSMA製剤により末期の転移性前立腺がん患者でも完全奏効を達成するほどの高い治療効果を示した(Kratochwil, JNM, 2016)。また、225Acと90Y製剤のタンデム治療(225Ac製剤の投与翌日に90Y製剤を投与する治療法)でさらに高い治療効果が報告された(Khreish, F. EJNMMI, 2019)。代表者の東は、AMED CiCLEで、225Acの国内供給のための製造技術開発に成功し、日本メジフィジックス社に技術導出した。医療用225Ac製造工場が建設され、稼働に向けて準備を進めている段階である。日本においても225Ac治療が実現する日は近いが、世界的にも現時点で承認された225Ac標識製剤が存在しない現状を考えれば、90Y及び225Acの両者の研究開発を行うべきであると考えている。
・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・
<文献> (JP22ck0106730)
76. Kaneko Y, Tanaka T, Fujisawa S, Li G, Satofuka H, Kaneko MK, Suzuki H, Kato Y.
Development of a Novel Anti-Human Glypican 5 Monoclonal Antibody (G5Mab-1) for Multiple Applications
BBREP, 43, 102140, https://doi.org/10.1016/j.bbrep.2025.102140, 2025 (PDF; preprint)
75. Satofuka H, Suzuki H, Tanaka T, Li G, Kaneko MK, Kato Y.
An Anti-Human EphA2 Monoclonal Antibody Ea2Mab-7 Shows High Sensitivity for Flow Cytometry, Western Blot, and Immunohistochemical Analyses
Biochem Biophys Rep, 42, 1019982024, 2025 (PDF; preprint)
74. Li G, Suzuki H, Tanaka T, Satofuka H, Kaneko MK, Kato Y.
A novel anti-mouse CXCR1 monoclonal antibody, Cx1Mab-8, demonstrates nanomolar affinity in flow cytometry
Biochem Biophys Rep, 42, 101965, 2025 (PDF; preprint)
73. Tanaka T, Kaneko Y, Yamamoto H, Li G, Fujisawa S, Satofuka H, Shinoda K, Nakamura T, Kaneko MK, Suzuki H, Kato Y.
Development of a novel anti-erythropoietin-producing hepatocellular receptor B6 monoclonal antibody Eb6Mab-3 for flow cytometry
Biochem Biophys Rep, 41, 101960, https://doi.org/10.1016/j.bbrep.2025.101960, 2024 (PDF; preprint)
72. Satofuka H, Suzuki H, Tanaka T, Ubukata R, Hirose M, Yamamoto H, Kaneko Y, Fujisawa S, Li G, Kaneko MK, Kato Y.
A novel Anti-Mouse CCR7 Monoclonal Antibody, C7Mab-7, Demonstrates High Sensitivity in Flow Cytometry, Western Blot, and immunohistochemistry
Biochem Biophys Rep, 41, 101948, https://doi.org/10.1016/j.bbrep.2025.101948, 2025 (PDF; preprint)
71.Ishikawa K, Suzuki H,Tanaka T,Kaneko MK, Kato Y.
Establishment of a high-affinity anti-mouse CXCR5 monoclonal antibody for flow cytometry
MI, 2(1), 101–113; https://doi.org/10.36922/mi.5664, 2025 (PDF; preprint)
70. Kaneko MK, Suzuki H, Ohishi T, Nakamura T, Yanaka M, Tanaka T, Kato Y.
A Humanized Cancer-Specific anti-HER2 Monoclonal Antibody, humH2Mab-250, Exerts Antitumor Activities in Human Breast Cancer Xenograft Models
Int. J. Mol. Sci., 2025(PDF; preprint)
69. Tanaka T, Suzuki H, Ohishi T, Kaneko MK, Kato Y.
A Cancer-Specific anti-Podoplanin Monoclonal Antibody, PMab-117-mG2a Exerted Antitumor Activities in Human Tumor Xenograft Models
Cells, 13(22), 1833; https://doi.org/10.3390/cells13221833, 2024 (PDF; preprint)
68. Hirose M, Suzuki H, Ubukata R, Tanaka T, Kaneko MK, Kato Y.
Development of specific anti-mouse atypical chemokine receptor 4 monoclonal antibodies
Biochem Biophys Rep, 40, 101824, https://doi.org/10.1016/j.bbrep.2024.101824, 2024 (PDF; preprint)
67. Ishikawa K, Suzuki H, Ohishi T, Nakamura T, Yanaka M, Li G, Tanaka T, Kawada M, Kaneko MK, Ohkoshi A, Katori Y, Kato Y.
Antitumor activities of defucosylated anti-CD44 monoclonal antibodies in mouse xenograft models of esophageal cancer
Oncology reports, 52(5), 147, https://doi.org/10.3892/or.2024.8806, (PDF; preprint)
66. Ishikawa K, Suzuki H, Ohishi T, Li G, Tanaka T, Kawada M, Ohkoshi A, Kaneko MK, Katori Y, Kato Y.
Anti-CD44 variant 10 monoclonal antibody exerts antitumor activity in mouse xenograft models of oral squamous cell carcinomas
Int. J. Mol. Sci., 25(17), 9190; https://doi.org/10.3390/ijms25179190, 2024 (PDF; preprint)
65. Ubukata R, Suzuki H, Tanaka T, Li G, Kaneko MK, Kato Y.
Development of Sensitive Anti-Mouse CCR5 Monoclonal Antibodies using the N-terminal peptide immunization
Monoclon. Antib. Immunodiagn. Immunother., 43(4), 112-118, https://doi.org/10.1089/mab.2024.0009, 2024 (PDF)
64. Suzuki H, Tanaka T, Li G, Ouchida T, Kaneko MK, Kato Y.
Development of a Sensitive Anti-Mouse CCR5 Monoclonal Antibody for Flow Cytometry
Monoclon. Antib. Immunodiagn. Immunother., 43(4), 96-100, https://doi.org/10.1089/mab.2024.0004, 2024 (PDF; preprint)
63. Kobayashi H, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-Mouse CCR8 Monoclonal Antibody C8Mab-2 using flow cytometry
Monoclon. Antib. Immunodiagn. Immunother., 43(4), 101-107, https://doi.org/10.1089/mab.2024.0002, 2024 (PDF; preprint)
62. Suzuki H, Ohishi T, Tanaka T, Kaneko MK, Kato Y.
Anti‐HER2 cancer‐specific mAb, H2Mab‐250‐hG1 possesses higher complement‐dependent cytotoxicity than trastuzumab
Int. J. Mol. Sci., 25(15), 8386; https://doi.org/10.3390/ijms25158386, 2024 (PDF; preprint)
61. Arimori T, Mihara E, Suzuki H, Ohishi T, Tanaka T, Kaneko MK, Takagi J, Kato Y.
Locally misfolded HER2 expressed on cancer cells is a promising target for development of cancer-specific antibodies
Structure, 32(5),536-549, https://doi.org/10.1016/j.str.2024.02.007, 2024 (PDF)
60. Li G, Tanaka T, Suzuki H, Kaneko MK, Kato Y.
Cx1Mab-1: A Novel Anti-mouse CXCR1 Monoclonal Antibody for Flow Cytometry
Monoclon. Antib. Immunodiagn. Immunother.,43(2), 59-66, DOI: 10.20944/preprints202311.0501.v2, 2023 (PDF;preprint)
59. Ouchida T, Li G, Suzuki H, Yanaka M, Nakamura T, Handa S, Tanaka T, Kaneko MK, Kato Y.
PMab-314: An Anti-Giant Panda Podoplanin Monoclonal Antibody
Monoclon. Antib. Immunodiagn. Immunother.,43(2), 53-58, doi:10.1089/mab.2024.0003, 2024 (PDF)
58. Kaneko MK, Suzuki H, Kato Y.
Establishment of a novel cancer-specific anti-HER2 monoclonal antibody H2Mab-250/H2CasMab-2 for breast cancers
Monoclon. Antib. Immunodiagn. Immunother.,43(2), 35-43,
DOI: 10.1089/mab.2023.0033, 2024 (PDF;online;preprint)
57. Ouchida T, Isoda Y, Nakamura T, Yanaka M, Tanaka T, Handa S, Kaneko MK, Suzuki H, Kato Y.
Establishment of a Novel Anti-Mouse CCR1 Monoclonal Antibody C1Mab-6
Monoclon. Antib. Immunodiagn. Immunother.,43(2), 67-74, https://doi.org/10.1089/mab.2023.0032, 2024 (PDF;preprint)
56. Okada Y, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-Mouse CD39 Monoclonal Antibody using PA Scanning and RIEDL Scanning
Monoclon. Antib. Immunodiagn. Immunother.,43(2), 44-52, https://doi.org/10.1089/mab.2023.0029, 2024 (PDF;preprint)
55. Inoue T, Yamamoto Y, Sato K, Nakamura Y, Shimizu Y, Ogawa M, Onodera T, Takahashi Y, Wakita T, Kaneko MK, Fukasawa M, Kato Y, Noguchi K.
Overcoming antibody-resistant SARS-CoV-2 variants with bispecific antibodies constructed using non-neutralizing antibodies
iScience,27(4),109363, DOI:https://doi.org/10.1016/j.isci.2024.109363, 2024 (PDF)
54. Ouchida T, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Establishment of anti-dog PD-L1 monoclonal antibodies for immunohistochemistry
Monoclon. Antib. Immunodiagn. Immunother., 43(1), 17–23, https://doi.org/10.1089/mab.2023.0014, 2024 (PDF; preprint)
53. Okada Y, Suzuki H, Kaneko MK, Kato Y.
Development of a Sensitive Anti-Mouse CD39 Monoclonal Antibody (C39Mab-1) for Flow Cytometry and Western Blot Anal-yses
Monoclon. Antib. Immunodiagn. Immunother., 43(1), 24–31, https://doi.org/10.1089/mab.2023.0016, 2024 (PDF; preprint)
52. Ouchida T, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Cx4Mab-1: a Novel Anti-mouse CXCR4 Monoclonal Antibody for Flow Cytometry
Monoclon. Antib. Immunodiagn. Immunother., 43(1), 10–16, DOI: 10.1089/mab.2023.0023, 2024 (PDF;preprint)
51. Kaneko MK, Suzuki H, Ohishi T, Nakamura T, Tanaka T, Kato Y.
A Cancer-specific Monoclonal Antibody against HER2 Exerts Antitumor Activities in Human Breast Cancer Xenograft Models
Int. J. Mol. Sci., 25(3), 1941; https://doi.org/10.3390/ijms25031941, 2024 (PDF)
50. Tanaka T, Suzuki H, Ohishi T, Kaneko MK, Kato Y.
Antitumor activities against breast cancers by an afucosylated anti-HER2 monoclonal antibody H2Mab-77-mG2a-f
Cancer Sci., 115(1), 298-309, https://doi.org/10.1111/cas.16008, 2024 (PDF; preprint)
49. Suzuki H, Ohishi T, Tanaka T Kaneko MK, Kato Y.
A Cancer-Specific Monoclonal Antibody against Podocalyxin Exerted Antitumor Activities in Pancreatic Cancer Xenografts
Int. J. Mol. Sci., 25, 161. https://doi.org/10.3390/ijms25010161, 2024 (PDF; preprint)
48. Isoda Y, Kaneko MK, Tanaka T, Suzuki H, Kato Y.
Epitope Mapping of an Anti-Ferret Podoplanin Monoclonal Antibody using the PA Tag-Substituted Analysis
Monoclon. Antib. Immunodiagn. Immunother., 42(6), 189–193, DOI: 10.1089/mab.2023.0026, 2023 (PDF; preprint)
47. Ouchida T, Tanaka T, Suzuki H, Kaneko MK, Kato Y.
PMab-301: An Anti-Giraffe Podoplanin Monoclonal Antibody for Immunohistochemistry
Monoclon. Antib. Immunodiagn. Immunother., 42(6), 209–215, https://doi.org/10.1089/mab.2023.0020, 2023 (PDF; preprint)
46. Suzuki H, Tanaka T, Kudo Y, Tawara M, Hirayama A, Kaneko MK, Kato Y.
A Rat Anti-Mouse CD39 Monoclonal Antibody for flow cytometry
Monoclon. Antib. Immunodiagn. Immunother., 42(6), 203–208, DOI: 10.1089/mab.2023.0018, 2023 (PDF; preprint)
45. Nanamiya R, Suzuki H, Kaneko MK, Kato Y.
Development of an Anti−EphB4 Monoclonal Antibody for Multiple Applications against Breast Cancers
Monoclon. Antib. Immunodiagn. Immunother.,42(5), 153–156, https://doi.org/10.1089/mab.2023.0015, 2023 (PDF; preprint)
44. Suzuki H, Ohishi T, Kaneko MK, Kato Y.
Humanized and defucosylated antibody against Podoplanin (humLpMab-23-f) exerted antitumor activities in human tumor xenograft models
Cancers, 15(20), 5080; https://doi.org/10.3390/cancers15205080, 2023 (PDF)
43. Suzuki H, Ohishi T, Nanamiya R, Kawada M, Kaneko MK, Kato Y.
Defucosylated Monoclonal Antibody (H2Mab-139-mG2a-f) Exerted Antitumor Activities in Mouse Xenograft Models of Breast Cancers against Human Epidermal Growth Factor Receptor 2
Curr. Issues Mol. Biol., 45(10), 7734-7748; https://doi.org/10.3390/cimb45100488, 2023 (PDF)
42. Tanaka T, Kitamura K, Suzuki H, Kaneko MK, Kato Y.
Establishment of a Novel Anti-Human CCR6 Monoclonal Antibody C6Mab-19 with the High Binding Affinity in Flow Cytometry
Monoclon. Antib. Immunodiagn. Immunother., 42(4), 117–124, https://doi.org/10.1089/mab.2023.0004, 2023 (preprint; PDF)
41. Ouchida T, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Development of Highly Sensitive Anti-Mouse HER2 Monoclonal Antibodies for Flow Cytometry
Int. J. Transl. Med., 3(3), 310-320; 2023 (PDF)
40. Suzuki H, Goto N, Tanaka T, Ouchida T, Kaneko MK, Kato Y.
Development of a Novel Anti-CD44 Variant 8 Monoclonal Antibody C44Mab-94 against Gastric Carcinomas
antibodies, 12(3), 45; https://doi.org/10.3390/antib12030045, 2023 (PDF)
39. Ishikawa K, Suzuki H, Kaneko MK, Kato Y.
A Novel Anti-CD44 Variant 10 Monoclonal Antibody is Useful for Immunohistochemical Analysis against Oral Squamous cell carcinomas
Curr. Issues Mol. Biol., 45(7), 5248-5262; https://doi.org/10.3390/cimb45070333, 2023 (PDF)
38. Goto N, Suzuki H, Tanaka T, Ishikawa K, Ouchida T, Kaneko MK, Kato Y.
EMab-300 Detects Mouse Epidermal Growth Factor Receptor-Expressing Cancer Cell Lines in Flow Cytometry
antibodies, 12(3), 42, doi: 10.20944/preprints202305.0641.v1, 2023 (PDF)
37. Suzuki H, Kitamura K, Goto N, Ishikawa K, Ouchida T, Tanaka T, Kaneko MK, Kato Y.
A Novel Anti-CD44 Variant 3 Monoclonal Antibody C44Mab-6 was Established for Multiple Applications
Int. J. Mol. Sci., 24(9), 8411; https://doi.org/10.3390/ijms24098411, 2023 (PDF)
36. Kudo Y, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Development of a Novel Anti-CD44 Variant 5 Monoclonal Antibody C44Mab-3 for Multiple Applications against Pancreatic Carcinomas
antibodies, 12(2), 31, https://doi.org/10.3390/antib12020031, 2023 (PDF)
35. Isoda Y, Tanaka Y, Suzuki H, Asano T, Kitamura K, Kudo Y, Ejima R, Ozawa K, Yoshikawa T, Kaneko MK, Kato Y.
Epitope Mapping of the Novel Anti-human CCR9 Monoclonal Antibody (C9Mab-11) by 2 × Alanine Scanning
Monoclon. Antib. Immunodiagn. Immunother., 42(2), 73–76, https://doi.org/10.1089/mab.2022.0035, 2023 (PDF)
34. Tateyama N, Asano T, Tanaka T, Isoda T, Okada Y, Kobayashi H, Li G, Nanamiya R, Yoshikawa T, Kaneko MK, Suzuki H, Kato Y.
Epitope Mapping of Anti-mouse CCR3 Monoclonal Antibodies (C3Mab-6 and C3Mab-7)
Monoclon. Antib. Immunodiagn. Immunother., 42(2), 68–72, https://doi.org/10.1089/mab.2022.0034, 2023 (PDF)
33. Suzuki H, Ozawa K, Tanaka T, Kaneko MK, Kato Y.
Development of a Novel Anti-CD44 Variant 7/8 Monoclonal Antibody C44Mab-34 for Multiple Applications against Oral Carcinomas
Biomedicines, 11(4), 1099; https://doi.org/10.3390/biomedicines11041099, 2023 (PDF)
32. Li G, Suzuki H, Tanaka T, Asano T, Yoshikawa T, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-EpCAM Monoclonal Antibody (EpMab-37) using the Alanine Scanning Method
Monoclon. Antib. Immunodiagn. Immunother., 42(1), 41–47, doi: 10.1089/mab.2022.0031, 2023 (PDF)
31. Kobayashi H, Asano T, Suzuki H, Tanaka T, Yoshikawa T, Kaneko MK, Kato Y.
Establishment of a Sensitive Monoclonal Antibody against Mouse CCR9 (C9Mab-24) for Flow Cytometry
Monoclon. Antib. Immunodiagn. Immunother., 42(1), 15–21, https://doi.org/10.1089/mab.2022.0032, 2022 (PDF)
30. Nanamiya R, Ohishi T, Suzuki H, Mizuno T, Yoshikawa T, Asano T, Tanaka T, Kaneko MK, Kato Y.
Defucosylated mouse-dog chimeric anti-HER2 monoclonal antibody (H77Bf) exerts antitumor activities in mouse xenograft models of canine osteosarcoma
Monoclon. Antib. Immunodiagn. Immunother., 42(1), 27–33, doi:10.1089/mab.2022.0022, 2022 (PDF)
29. Suzuki H, Asano T, Ohishi T, Yoshikawa T, Suzuki H, Mizuno T, Tanaka T, Kawada M, Kaneko MK, Kato Y.
Antitumor Activities in Mouse Xenograft Models of Canine Fibroblastic Tumor by Defucosylated Mouse-Dog Chimeric Anti-HER2 Monoclonal Antibody (H77Bf)
Monoclon. Antib. Immunodiagn. Immunother., 42(1), 34–40, doi: 10.1089/mab.2022.0023, 2022 (PDF)
28. Isoda Y, Tanaka T, Suzuki H, Asano T, Yoshikawa T, Kitamura K, Kudo Y, Ejima R, Ozawa K, Kaneko MK, Kato Y.
Epitope Mapping using the Cell-Based 2×Alanine Substitution Method about the Anti-mouse CXCR6 Monoclonal Antibody, Cx6Mab-1
Monoclon. Antib. Immunodiagn. Immunother., 42(1), 22–26, doi: 10.1089/mab.2022.0029, 2022 (PDF)
27. Suzuki H, Tanaka T, Goto N, Kaneko MK, Kato Y.
Development of a novel anti-CD44 variant 4 monoclonal antibody C44Mab-108 for immunohistochemistry
Curr. Issues Mol. Biol., 45(3), 1875-1888; https://doi.org/10.3390/cimb45030121, 2023 (PDF)
26. Ejima R, Suzuki H, Tanaka T, Asano T, Kaneko MK, Kato Y.
Development of a Novel Anti-CD44 variant 6 Monoclonal Antibody C44Mab-9 for Multiple Applications against Colorectal Carcinomas
Int. J. Mol. Sci., 24(4), 4007; https://doi.org/10.3390/ijms24044007, 2023 (PDF)
25. Kobayashi H, Asano T, Tanaka T, Suzuki H, Kaneko MK, Kato Y.
Determination of the Binding Epitope of an Anti-mouse CCR9 Monoclonal Antibody (C9Mab-24) using the 1 × alanine and 2 × alanine-substitution Method
antibodies, 12(1), 11; https://doi.org/10.3390/antib12010011, 2023 (PDF)
24. Li G, Suzuki H, Ohishi T, Asano T, Tanaka T, Yanaka M, Nakamura T, Yoshikawa T, Kawada M, Kaneko MK, Kato Y.
Antitumor activities by a defucosylated anti-EpCAM monoclonal antibody in colorectal carcinoma xenograft models
Int J Mol Med, 51(2), 18, https://doi.org/10.3892/ijmm.2023.5221, 2023 (PDF)
23. Asano T, Tanaka T, Suzuki H, Li G, Nanamiya R, Tateyama N, Isoda Y, Okada Y, Kobayashi H, Yoshikawa T, Kaneko MK, Kato Y.
Development of a Novel Anti-Mouse CCR6 Monoclonal Antibody (C6Mab-13) by N-Terminal Peptide Immunization
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 343–349, doi: 10.1089/mab.2022.0021, 2022 (PDF)
22. Tanaka T, Suzuki H, Asano T, Li G, Nanamiya R, Tateyama N, Isoda Y, Okada Y, Kobayashi H, Yoshikawa T, Kaneko MK, Kato Y.
Epitope mapping of an Anti-Mouse CCR2 Monoclonal Antibody (C2Mab-6) using Enzyme-Linked Immunosorbent Assay
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 339–342, doi:10.1089/mab.2022.0020, 2022 (PDF)
21. Saito M, Suzuki H, Tanaka T, Asano T, Kaneko MK, Kato Y.
Development of an Anti-Mouse CCR8 Monoclonal Antibody (C8Mab-1) for Flow cytometry and Immunocytochemistry
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 333–338, https://doi.org/10.1089/mab.2021.0069, 2022 (PDF)
20. Kawabata H, Ohishi T, Suzuki H, Asano T, Kawada M, Suzuki H, Kaneko MK, Kato Y.
A Defucosylated Mouse Anti-CD10 Monoclonal Antibody (31-mG2a-f) Exerts Antitumor Activity in a Mouse Xenograft Model of Renal Cell Cancers
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 320–327, https://doi.org/10.1089/mab.2021.0049, 2022 (PDF)
19. Nanamiya R, Suzuki H, Takei J, Li G, Goto N, Harada H, Saito M, Tanaka T, Asano T, Kaneko MK, Kato Y.
Development of Monoclonal Antibody 281-mG2a-f Against Golden Hamster Podoplanin
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 311–319, https://doi.org/10.1089/mab.2021.0058, 2022 (PDF)
18. Tanaka T, Suzuki H, Isoda Y, Asano T, Nakamura T, Yanaka M, Handa S, Takahashi N, Okuno S, Yoshikawa T, Li G, Nanamiya R, Goto N, Tateyama N, Okada Y, Kobayashi H, Kaneko MK, Kato Y.
Development of a Sensitive Anti-human CCR9 Monoclonal Antibody (C9Mab-11) by N-terminal Peptide Immunization
Monoclon. Antib. Immunodiagn. Immunother., 41(6), 303–310, doi: 10.1089/mab.2022.0027, 2022 (PDF)
17. Tateyama N, Asano T, Suzuki H, Li G, Yoshikawa T, Tanaka T, Kaneko MK, Kato Y.
Epitope Mapping of Anti-mouse CCR3 Monoclonal Antibodies using Flow Cytometry
antibodies, 11(4), 75; https://doi.org/10.3390/antib11040075, 2022 (PDF)
16. Asano T, Tanaka T, Suzuki H, Li G, Ohishi T, Kawada M, Yoshikawa T, Kaneko MK, Kato Y.
A Defucosylated Anti-EpCAM Monoclonal Antibody (Ep-Mab-37-mG2a-f) Exerts Antitumor Activity in Xenograft Model
antibodies, 11(4), 74; https://doi.org/10.3390/antib11040074, 2022 (PDF)
15. Tateyama N, Suzuki H, Ohishi T, Asano T, Tanaka T, Mizuno T, Yoshikawa T, Kawada M, Kaneko MK, Kato Y.
Antitumor Activity of an anti-EGFR/HER2 Bispecific Antibody in a Mouse Xenograft Model of Canine Osteosarcoma
pharmaceutics,14(11), 2494; https://doi.org/10.3390/pharmaceutics14112494, 2022 (PDF)
14. Isoda Y, Tanaka T, Suzuki H, Asano T, Nakamura T, Yanaka M, Handa S, Komatsu Y, Okuno S, Takahashi N, Okada Y, Kobayashi H, Li G, Nanamiya R, Goto N, Tateyama N, Yoshikawa T, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-mouse CXCR6 Monoclonal Antibody (Cx6Mab-1) using the 2×Alanine scanning method
Monoclon. Antib. Immunodiagn. Immunother.,41(5),275–278, DOI: 10.1089/mab.2022.0019, 2022 (PDF)
13. Tanaka T, Suzuki H, Li G, Nanamiya R, Isoda Y, Okada Y, Kobayashi H, Yoshikawa T, Kaneko MK, Kato Y.
Epitope Mapping of the Anti-Human CCR2 Monoclonal Antibody (K036C2)
Monoclon. Antib. Immunodiagn. Immunother.,41(5),285–289, DOI: 10.1089/mab.2022.0018, 2022 (PDF)
12. Saito M, Suzuki H, Asano T, Tanaka T, Yoshikawa T, Kaneko MK, Kato Y.
KLMab-1: An Anti-Human KLRG1 Monoclonal Antibody for Immunocytochemistry
Monoclon. Antib. Immunodiagn. Immunother.,41(5),279–284, https://doi.org/10.1089/mab.2022.0016, 2022 (PDF)
11. Tanaka T, Li G, Saito M, Suzuki H, Asano T, Kaneko MK, Kato Y.
Development of an Anti-human CCR2 Monoclonal Antibody (C2Mab-9) by N-terminal Peptide Immunization
Monoclon. Antib. Immunodiagn. Immunother., 41(4), 188–193, https://doi.org/10.1089/mab.2022.0001, 2022 (PDF)
10. Kudo Y, Suzuki H, Kaneko MK, Kato Y.
Development of a Monoclonal Antibody PMab-295 Against Elephant Podoplanin
Monoclon. Antib. Immunodiagn. Immunother., 41(4), 194–201, https://doi.org/10.1089/mab.2022.0007, 2022 (PDF)
9. Asano T, Suzuki H, Tanaka T, Kaneko MK, Kato Y.
Identification of the Binding Epitope of an Anti-Mouse CCR4 Monoclonal Antibody, C4Mab-1
Monoclon. Antib. Immunodiagn. Immunother., 41(4), 214–220, https://doi.org/10.1089/mab.2022.0015, 2022 (PDF)
8. Okada Y, Suzuki H, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-Elephant Podoplanin Monoclonal Antibody (PMab-295) using Enzyme-Linked Immunosorbent Assay
Monoclon. Antib. Immunodiagn. Immunother., 41(4), 221–227, https://doi.org/10.1089/mab.2022.0017, 2022 (PDF)
7. Suzuki H, Ohishi T, Asano T, Tanaka T, Saito M, Mizuno T, Yoshikawa T, Kawada M, Kaneko MK, Kato Y.
Defucosylated mouse-dog chimeric anti-HER2 monoclonal antibody exerts antitumor activities in mouse xenograft models of canine tumors
Oncol. Rep.,,48(3), 154, https://doi.org/10.3892/or.2022.8366, 2022 (PDF)
6. Saito M, Suzuki H, Kaneko MK, Kato Y.
TgMab-2: An Anti-Human TIGIT Monoclonal Antibody for Immunocytochemistry
Monoclon. Antib. Immunodiagn. Immunother., 41(3), 157–162, https://doi.org/10.1089/mab.2022.0013, 2022 (PDF)
5. Tanaka T, Li G, Asano T, Kaneko MK, Suzuki H, Kato Y.
Epitope Mapping of the Anti-Human CCR2 Monoclonal Antibody C2Mab-9
Monoclon. Antib. Immunodiagn. Immunother., 41(3), 150–156, https://doi.org/10.1089/mab.2022.0012, 2022 (PDF)
4. Goto N, Suzuki H, Tanaka T, Asano T, Kaneko MK, Kato Y.
Epitope Mapping of an Anti-Chinese/golden Hamster Podoplanin Monoclonal Antibody
Monoclon. Antib. Immunodiagn. Immunother., 41(3), 163–169, https://doi.org/10.1089/mab.2022.0014, 2022 (PDF)
3. Kitamura K, Suzuki H, Kaneko MK, Kato Y.
Cx6Mab-1: a Novel Anti-mouse CXCR6 Monoclonal Antibody established by N-terminal Peptide Immunization
Monoclon. Antib. Immunodiagn. Immunother., 41(3), 133–141, https://doi.org/10.1089/mab.2022.0010, 2022 (PDF)
2. Li G, Suzuki H, Asano T, Tanaka T, Suzuki H, Kaneko MK, Kato Y.
Development of A Novel Anti-EpCAM Monoclonal Antibody for Various Applications
Antibodies, 11(2), 41; https://doi.org/10.3390/antib11020041, 2022 (PDF) (Preprint)
1. Goto N, Suzuki H, Tanaka T, Asano T, Kaneko MK, Kato Y.
Development of a novel anti-CD44 monoclonal antibody for multiple applications against esophageal squamous cell carcinomas
Int. J. Mol. Sci., 23(10), 5535; https://doi.org/10.3390/ijms23105535, 2022 (PDF) (Preprint)