
"Podoplanin"は腎臓の上皮細胞であるpodocyte(足細胞)から発見された糖タンパク質である。あるネフローゼのラットモデルにおいて、この糖タンパク質の発現減少と、podocyteのfoot process(足突起)がflat feet (Latin, pes planus:扁平足)になることが関係していることがわかった。このことから、この糖タンパク質は"podoplanin"(podo(足)+plan(us)(扁平)+-in(接尾語):すなわち扁平足)と名付けられた。"To indicate that this protein could be associated with transformation of arborized foot processes to flat feet (Latin, pes planus) we have called it podoplanin." (Breiteneder-Geleff, AJP, 1997)
がんが血管に侵入して血行性の転移をとる場合、血管内皮細胞表面に接着し、血管外へ浸潤する。この血行性転移において、癌細胞による血小板凝集が認められることが知られている。癌細胞は血管に侵入すると、宿主の免疫系による攻撃を受けたり、剪断応力(shear stress)によって即座に破壊され、0.01%以下の癌細胞しか生き残れない。しかし、血小板凝集を引き起こすことにより、この免疫系から逃れたり、物理的衝撃からも守られる。また、血小板は癌細胞の血管内皮細胞への接着を促したり、増殖因子を放出することにより、癌細胞の局所的な増殖を引き起こすことも知られている。さらに、癌細胞と血小板の塊(凝集塊)が、毛細血管に詰まることも血行性転移の促進に寄与しているとも考えられている。このように、癌細胞による血小板凝集は、癌の血行性転移の促進に関わっていることが考えられる。
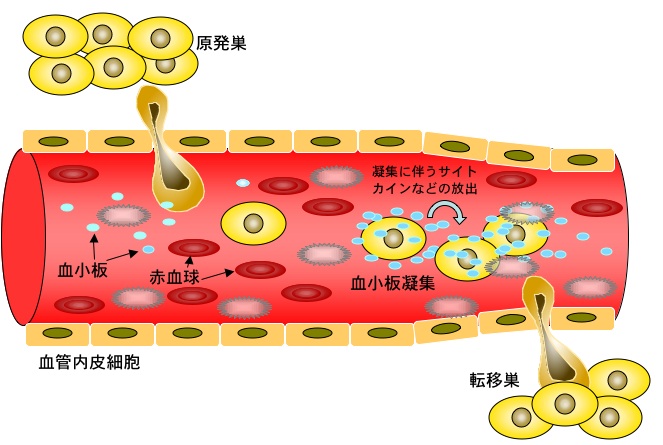
鶴尾らは、マウス結腸がん細胞株colon adenocarcinoma 26から、高転移性株NL-17細胞と低転移性株NL-14細胞を取得した1)。さらにNL-17細胞に高反応性を示し、NL-14細胞には低反応性を示すモノクローナル抗体8F11抗体を作成した2)。in vitroの実験で、NL-17細胞はマウスの血小板凝集を引き起こすが、8F11抗体によりその活性は阻害された。また、in vivoの実験で、NL-17細胞の実験的肺転移が8F11抗体の投与によって阻害された3)。これらのことから、NL-17細胞は8F11抗体に認識される血小板凝集因子gp44(後にAggrusと命名したが、現在はpodoplaninという名前で統一されている)によりマウス血小板を凝集し、その結果、肺転移を起こすことが示唆された。その後、豊島らは8F11抗体カラムとWGAカラムを使ってNL-17細胞からAggrusタンパク質を精製した4)。精製Aggrusは血漿成分非存在下で濃度依存的にマウスの血小板凝集を引き起こし、さらにこの凝集反応は8F11抗体によって完全に阻害された。これら一連の研究の後、Aggrus遺伝子の探索が続けられたが、タンパク質を精製してアミノ酸配列を決め、遺伝子を取得する正攻法では結果が得られなかった。
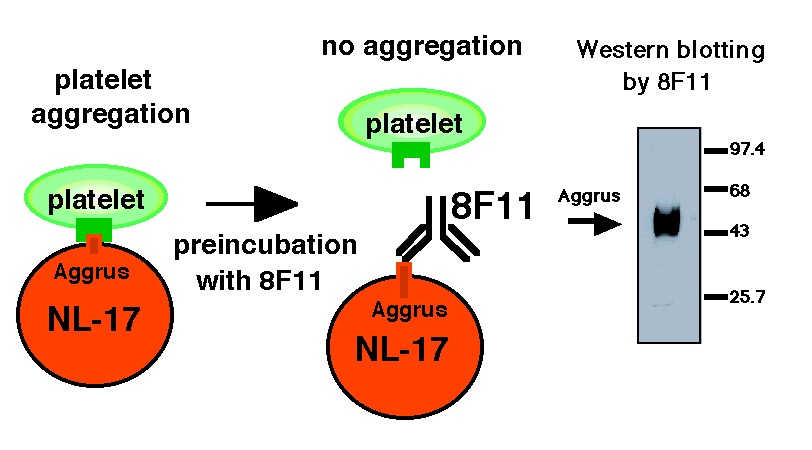
一方、次項で述べるように、ゲノムプロジェクトによる豊富な遺伝子情報をもとに、他の幾つかのグループが同じ分子に異なる名前をつけて独立に研究を行っていた。それらの分子とAggrusの多くの共通点に気づいた我々は、その遺伝子を発現させ、8F11抗体が認識している44kDaの糖タンパク質Aggrusの遺伝子本体を同定した5)。
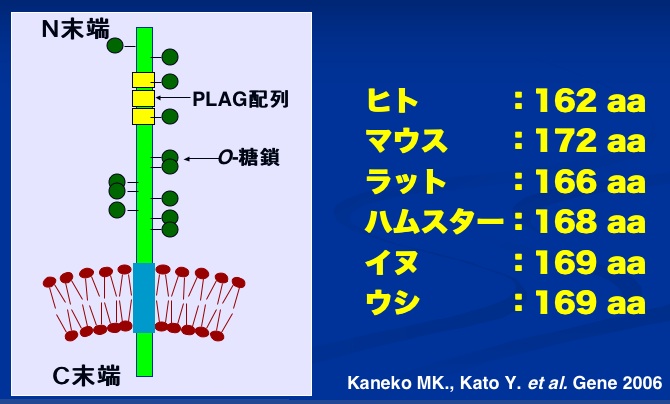
AggrusはC末端に膜貫通部位を有したI型膜貫通型タンパク質で、ヒトでは162アミノ酸、マウスでは172アミノ酸からなる糖タンパク質である。O-結合型糖鎖付加部位となりうるSer/Thrが、ヒトで38カ所、マウスで34カ所存在する。そのうち、実際にO-糖鎖が付加されると予想される部位はその半分である。さらに、Aggrusの糖鎖構造解析が近年終了し、実際に糖鎖が付加されている部位はさらに少なく、N末端から52番目のThrまでは全く糖鎖が付加されていないことがわかった。また、マウスではN-結合型糖鎖付加部位(Asp-X-Ser/Thrコンセンサス配列、XはPro以外)が1カ所あり、実際にN-結合型糖鎖が付加されていることが確認されている。(ポドプラニンの構造)
他のグループにより、Aggrusと分子量、組織分布、糖鎖の付加様式の類似した分子として、T1α、podoplaninなどの名称で、マウス、ラット、ヒト、イヌなどから遺伝子が取得された。マウスから遺伝子が単離されたOTS-8/gp38/E11 antigen/RANDAM-2、ラットから単離されたT1α/podoplanin/RTI40/PA2.26、イヌから単離されたgp40、ヒトから単離されたgp36などである。さらに我々はハムスター、ウシからも遺伝子を単離した。(現在はpodoplaninという名前で統一されている。)(History of podoplanin homologues (pdf download))
特にT1αとpodoplaninと名付けられた分子に関する研究がさかんに行われた。WilliamsらはT1αという名称を用い、この分子が肺のI型肺胞上皮細胞上に発現しており、II型の肺胞上皮細胞には発現していないことを示した6)。また、T1αは肺胞上皮幹細胞からI型肺胞上皮細胞への分化とともに発現されてくることも示された。さらにBreitenederらはpodoplaninという名称で、43kDaの糖タンパク質が腎の糸球体上皮細胞(podocyte)に発現しており、腎の微小変化群のラットモデルで発現が低下することを報告した7)。RamirezらによりT1αのノックアウト(KO)マウスが作製されたが、このマウスは呼吸不全により生後すぐに死亡した8)。さらに、Schachtらは、T1αのKOマウスではリンパ管の形成不全や先天的なリンパ水腫が見られることを報告した9)。 T1αはI型肺胞上皮細胞に選択的に発現していることから、II型肺胞上皮細胞と区別することができる選択的マーカーとして、多くの研究グループに利用されている。一方、podoplaninはリンパ管内皮細胞に発現し、血管内皮細胞に発現していないことから、リンパ管を血管と区別する特異的マーカーとして繁用され始めている。様々な臓器のがん、炎症性疾患、糸球体腎炎、移植腎においてリンパ管の増生が報告されており、podoplaninをリンパ管マーカーとして用いることで詳細な研究が可能となった。
抗ヒトpodoplanin抗体は数多く販売されているが、我々の作成したNZ-1抗体は感度、特異度が高く、有用性が高い。(抗podoplanin抗体の項目を参照)
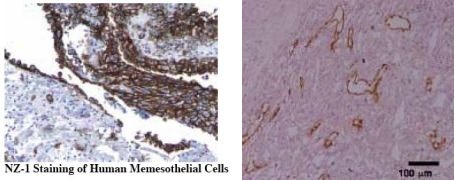
悪性中皮腫(左)とリンパ管内皮細胞(右)におけるAggrus/podoplaninの発現
これまで述べてきたように、Aggrus/podoplaninは,特異的リンパ管内皮マーカーとして知られている。さらに、様々な癌で発現が亢進していることが報告されている。(Immunohistochemistry of podoplanin (pdf download))
この表に挙げられているように、脳腫瘍、口腔癌(頭頸部癌)、食道癌、肺癌、悪性中皮腫、精巣腫瘍、子宮頚癌などのヒト腫瘍で発現が報告されてきた。それぞれの癌を組織型別に見てみると、組織型特異的にAggrus/podoplaninの発現が見られることがわかってきた。
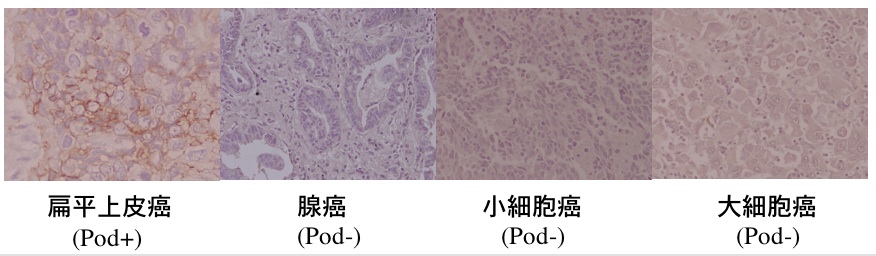
例えば、肺癌には、扁平上皮癌、腺癌、小細胞癌、大細胞癌などの組織型があるが、扁平上皮癌にのみ発現が見られる。(参考文献:Kato et al., BBRC, 2006)全身の癌を見てみると、胃や大腸の腺癌にはAggrus/podoplaninが発現しておらず、食道、頭頸部、子宮頸部の扁平上皮癌に発現が見られることからも、扁平上皮癌特異的にAggrus/podoplaninが発現しているようである。
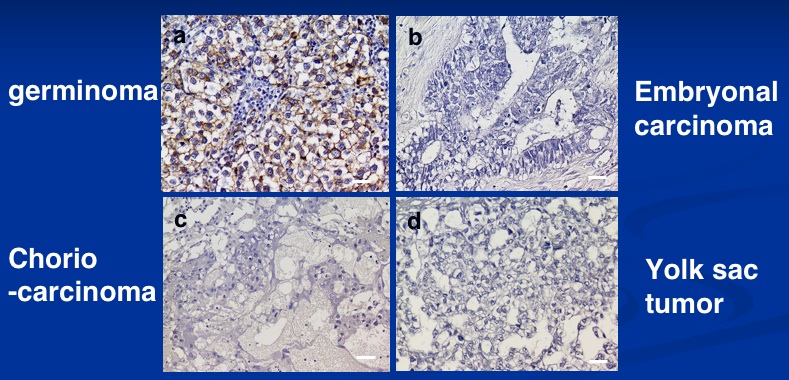
頭蓋内胚細胞腫にもいくつかの組織型があるが、その中で、germinnoma(胚腫)やimmature teratoma(未分化奇形腫)という組織型に特異的にAggrus/podoplaninの発現が見られた。
また、精巣腫瘍にもいくつかの組織型があるが、その中で、セミノーマという組織型に特異的にAggrus/podoplaninの発現が見られた。
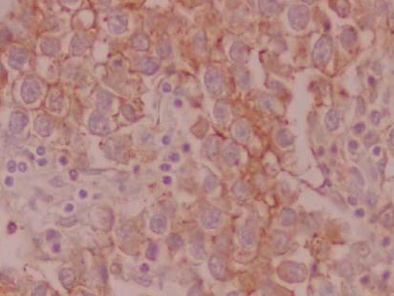
セミノーマにおけるAggrus/podoplaninの発現
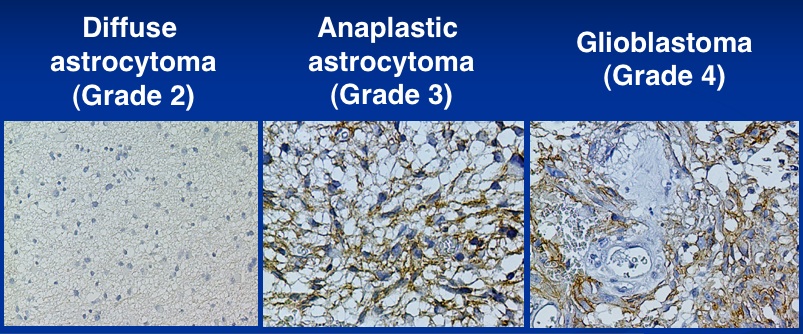
さらに組織型特異的発現が見られるだけでなく、悪性度とも相関してAggrus/podoplaninの発現が見られる例もある。例えば、脳腫瘍の中で、astrocytic tumor(星細胞系腫瘍)という分類があるが、星細胞腫 (WHO grade 2:diffuse astrocytoma),退形成性星細胞腫(グレード3:anaplastic astrocytoma)、膠芽腫(グレード4:glioblastoma)という臨床的分類がある。グレード2、3、4の順に悪性度が上がり、予後も悪い。Aggrus/podoplaninの発現はこのグレードが上がるに従って上昇することがわかっており、Aggrus/podoplaninの発現と悪性度との相関があることがわかった。(参考文献:Mishiima et al., AJP, 2006)
様々な癌細胞株や正常リンパ管内皮細胞株にもAggrus/podoplaninが発現しており、Aggrus/podoplaninの機能解析に使われている。(podoplaninの発現株について)
Aggrus/podoplaninは、マウスの実験モデルのおいて、癌の血行性転移に関わっていることが知られている(参考文献1、3)。さらに、頭頸部扁平上皮癌において、Aggrus/podoplaninの発現とリンパ節転移、患者の予後との正の相関関係があるという報告も出ており、Aggrus/podoplaninが頭頸部扁平上皮癌の予後マーカーとしての可能性も示唆されている(PubMed)。
Aggrus/podoplaninのタンパク質断片や点突然変異をもつAggrus/podoplaninに対する8F11抗体の反応性を検討した結果、マウスAggrus/podoplaninの39番目から44番目のアミノ酸配列(DGMVPP)を認識していることが明らかとなった。そこで8F11抗体に認識されない41番目のメチオニンをアラニンに置換した変異Aggrus/podoplanin(M41A)を作製しCHO細胞に発現させた。しかし、このM41A-Aggrusの血小板凝集能は野生型のものと大差なく、血小板上にある未知のレセプター分子とAggrus/podoplaninとの結合に関わる部位を8F11抗体が認識するために血小板凝集が阻害されているのではないことがわかった。
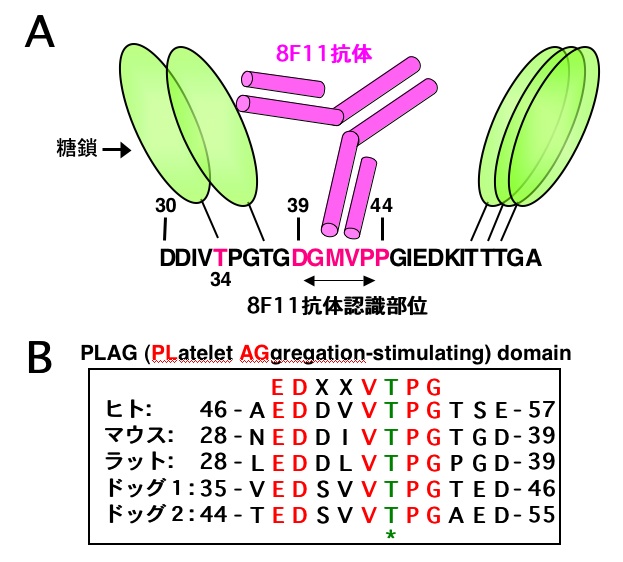
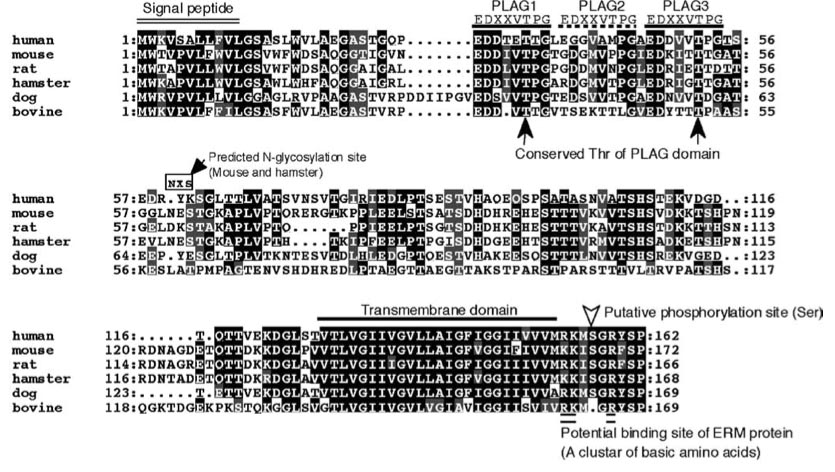
Aggrus/podoplaninには多数の糖鎖が付加されていること、Aggrus/podoplaninに付加されているシアル酸が血小板凝集活性に重要な役割を果たしているという結果から,8F11抗体はその認識部位に結合することにより、結合部位周辺に付加されている糖鎖の立体構造を変化させ、その結果Aggrus/podoplaninの血小板凝集活性が失われているものと予想し検討を行なった。点突然変異をもつAggrus/podoplaninを発現させその血小板凝集活性を検討した結果、糖鎖が付加されていると予想される34番目のスレオニンをアラニンに置換したT34A-Aggrusには、血小板凝集活性が認められないことを見いだした。糖鎖が血小板凝集活性に重要な働きをしていることは、糖鎖合成不全の変異CHO細胞(Lec2とLec8細胞)を用いることによっても証明されている。よって、34番目のスレオニンに付加されている糖鎖がAggrus/podoplaninによる血小板凝集に重要な働きをしていること、また8F11抗体はAggrus/podoplaninに結合することにより、その糖鎖を立体的に障害し血小板凝集活性を中和していること(steric hindrance)が明らかとなった。血小板凝集活性に重要な部位周辺のアミノ酸配列は種を超えて高度に保存されており、ヒト・ラット・ドッグAggrus/podoplaninの相同部位に変異を導入すると、その血小板凝集活性が失われた。よってわれわれはこの部位をPLAG(PLatelet AGgregation-stimulating)domainと命名した。
Podoplanin/Aggrusの血小板凝集活性部位(PLAG domain)の詳細な糖鎖構造解析を行った。抗ヒトpodoplanin抗体(NZ-1)を用いて、内在性のヒトpodoplaninの精製に初めて成功した。ヒトpodoplaninのPLAG domainには、数カ所のSer/Thr(O-結合型糖鎖の付加部位)が存在する。
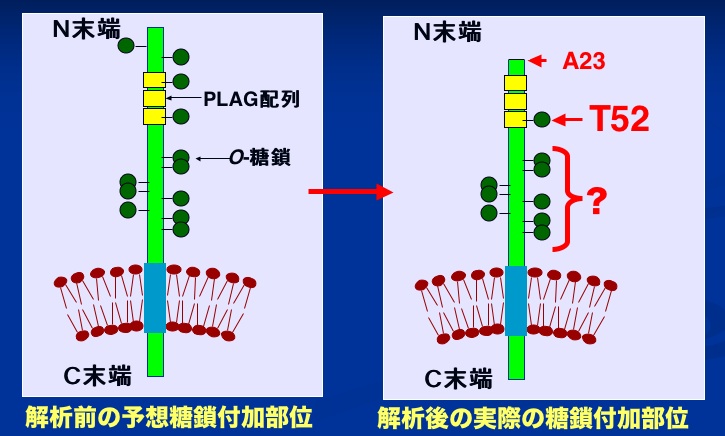
以前の研究で、Thr52に変異を入れると血小板凝集活性が消失したが、PLAG domainの他のSer/Thr(Thr32, Thr34, Thr35, Thr55, Ser56)に付加した糖鎖も血小板凝集活性に関わっているかどうかが不明であった。
まず、Edman分解法により、N末がAla23であることがわかり、予想されていたよりもPLAG domainがN末端に近いことがわかった。さらに糖鎖付加部位を決定したところ、Thr32, Thr34, Thr35, Thr55, Ser56には糖鎖が付加されておらず、Thr52のみに糖鎖が付加されていることがわかった。
23-57 a.aの糖ペプチドをMSによって解析したところ、disialyl-core1構造(NeuAcα2-3Galβ1-3(NeuAcα2-6)GalNAcα1-O-Thr)やmonosialyl-core1構造(NeuAcα2-3Galβ1-3GalNAcα1-O-Thr)が付加されていることがわかった。(Kaneko et al., FEBS, 2007)
さらに、PLAG domainの Thr52のみにO-結合型糖鎖を付加した様々な糖ペプチドをin vitroで合成し、レセプターであるCLEC-2(詳細は次の項目に記載)との反応性を調べたところ、disialyl-core1 構造を付加した糖ペプチドのみがCLEC-2と高い反応性を示した。以上の詳細な解析により、ヒトPodoplaninによる血小板凝集の活性中心は、PLAG domainのThr52に付加されたdisialyl-core1構造であることが明らかとなった。(Kato et al., Cancer Science, 2008)
癌細胞による血小板凝集と転移との相関は古くから知られていた。この血小板凝集を引き起こす膜分子として、Aggrus/podoplanin(当時gp44と言われていた)が、1988年のCancer Res. (Watanabe et al.)に発表された。マウス結腸癌細胞colon26、特に高転移性株NL17細胞にpodoplanin が高発現しており、血小板凝集を引き起こすことが報告された。この発見から長い間、血小板上のpodoplaninレセプターが不明であった。
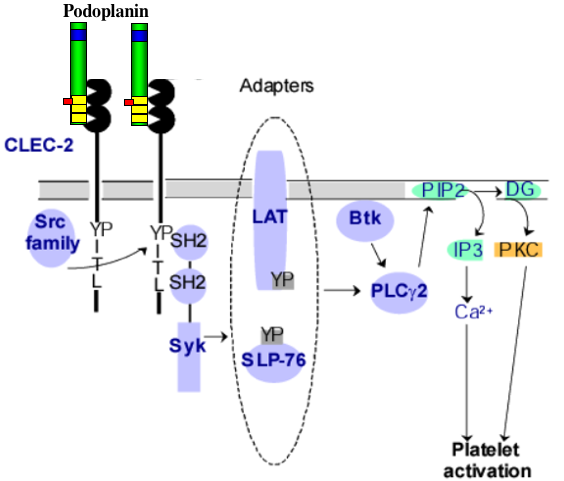
癌細胞上のpodoplaninによる血小板凝集活性の発見から約20年経った2007年になり、ようやく血小板上のpodoplaninレセプターの同定がなされた(Suzuki-Inoue et al., JBC2007)。その分子は、C型レクチン様レセプターの一つであるCLEC-2(クレック-2)である。
井上らは、まずpodoplanin誘導性の血小板凝集パターン(lag timeが長い)に注目した。また、podoplaninによる血小板凝集経路には、Srcが関係していることもわかった。同様の血小板凝集パターンを示すものとして、GPVIを介するコラーゲンによる血小板凝集や蛇毒ロドサイチンによる血小板凝集が候補として挙がってきた。しかし、podoplaninはGPVIのノックアウトマウスに対して血小板凝集を引き起こしたことから、GPVIはpodoplaninのレセプターではないことがわかった。
次に、ロドサイチンによる凝集パターンとの比較を行った。PLCgamma2のノックアウトマウスを用い、podoplaninによる血小板凝集を調べたところ、ロドサイチンと同様に血小板凝集が見られなかった。2006年井上らにより、ロドサイチンのレセプターとしてCLEC-2が同定されており、podoplaninのレセプターとしてCLEC-2が考えられた。そこで、CLEC-2のFcキメラや膜型発現株を作製し、podoplaninとの結合をflow cytometryで調べたところ、podoplaninとCLEC-2が特異的に結合した。さらに、CLEC-2のFcキメラによってpodoplaninによる血小板凝集が阻害された。また、podoplaninの活性部位であるシアル酸がCLEC-2との結合に重要であることもわかり、podoplaninの血小板上レセプターがCLEC-2であることが証明された。
我々が作製した抗ヒトpodoplanin抗体(NZ-1)は、podoplaninとCLEC-2との結合を阻害した。さらに、NZ-1はpodoplaninによる血小板凝集も濃度依存的に阻害した。また、NZ-1抗体をCHO/hAGRと共に尾静注すると、肺転移も有意に抑制した。以上の結果より、ヒトpodoplaninは、CLEC-2に結合することにより血小板凝集を起こし、さらに血行性転移に重要な役割を果たすことが示された。(Kato et al., Cancer Science, 2008)
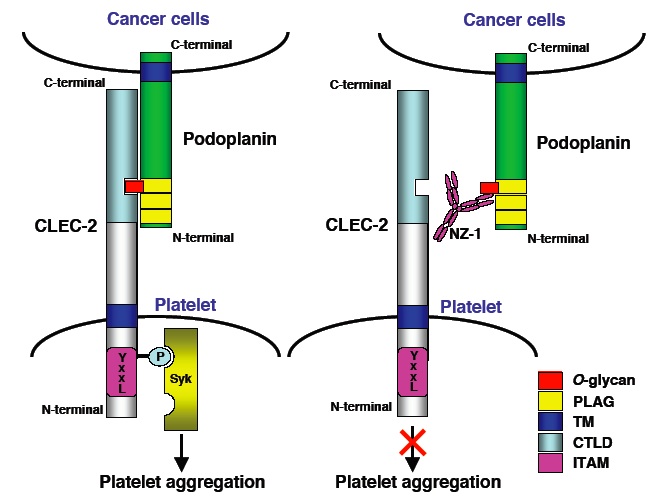
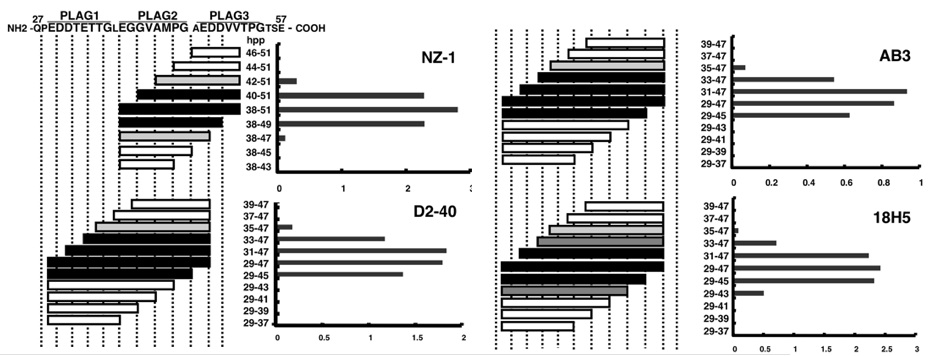
我々はこれまでに、ヒトポドプラニンに特異的に反応するラットモノクローナル抗体NZ-1を樹立した。また、他の抗ポドプラニン抗体として、D2-40(各社から販売されているマウス抗ヒトポドプラニン抗体)やAB3(AngioBio社から販売されているマウス抗ヒトポドプラニン抗体)、18H5というクローンがよく知られており、これらのエピトープの比較を行った。以下の図に示す通り、NZ-1はポドプラニンのPLAG(Platelet aggregation-stimulating)domainの三回繰り返し構造のうちのPLAG-2/3を認識するのに対し、他の抗体はPLAG-1/2を認識することがわかった。特に、D2-40とAB3に関しては、全く同じエピトープであることがわかった。さらに、Flow cytometryにおいても、この結果が確かめられた。興味深いことに、NZ-1抗体のみが、ポドプラニンとCLEC-2の相互作用を阻害し、さらにポドプラニンによる血小板凝集活性を阻害することから、NZ-1抗体のエピトープであるPLAG-2/3がポドプラニンの活性に重要であることが明らかとなった。
D2-40とAB3のエピトープが全く同じであることや、その他の詳細な解析から、驚くべきことに、この2つの抗体は全く同じクローン由来でないかと推測される。(すなわち、AngioBio社がD2-40を開発者から購入し、クローン名を付けないで抗ポドプラニン抗体として販売したのかもしれない。AngioBio社に問い合わせたところ、クローン名はAB3であるとしてきた。カタログではクローン名を示していないが、カタログ番号が003であることから、AB3というクローン名(AngioBioの003の略)を付けたと思われる。)
これまで、様々な論文において、D2-40とポドプラニンの違いの検討(このポドプラニンというのは、AB3抗体を使っている)というような内容が報告されてきた。それらの論文を見ると、IHCにおける染色条件が異なっている。D2-40は抗原賦活化を推奨しており、AB3は抗原賦活化が必要ないとされているので、その条件の通りにIHCの比較がされていることが多い。そのため、同一の抗体を使っても染色条件が異なることから、異なる染色結果になってしまったようである。
(Ogasawara et al., Hybridoma, 2008)
我々は10年以上に渡って、ポドプラニンの基礎的研究を行ってきた。その最終目標は、癌に苦しむ患者さんを直すことにある。いよいよポドプラニンの研究も、臨床応用に向けて一歩前進した。
本研究ではまず、抗ポドプラニン抗体NZ-1抗体の親和性を調べた。BIAcoreを用いると、NZ-1の解離定数KD値は1.2 x 10^-10 Mという値を示し、その抗原ペプチドに対して高い親和性を持つことが示された。また、ポドプラニンを高発現する2種類のグリオブラストーマ細胞を用いてScatchard解析を行うと、解離定数KD値は9.8x 10^-10 Mという値(D397MG細胞の場合)を示し、やはり非常に高い親和性を持つことがわかった。高い親和性は、抗体治療において必須の条件であり、NZ-1抗体が抗体医薬に有用であることが示された。
次に、NZ-1抗体のinternalization assay(内在化解析)を行った。抗体に毒素を結合させ、抗体医薬としての応用しようとする試みが米国NIHを中心に進んでいるが、その際、抗体の内在化が必須の条件となる。本研究においては、[131-I]SGMIBラベルしたNZ-1のLN319細胞に対する内在化を調べた結果、抗体処理後8時間後に、26%程度内在化が観察された。これは、過去の他の抗体の内在化と比べても、非常に良い内在化であり、毒素型NZ-1抗体の開発を進めるデータとなった。
さらに、NZ-1抗体の腫瘍集積性をin vivoの移植片モデルで調べた。グリオブラストーマの移植片モデルとしてDuke大学で開発されたD2159MG細胞を皮下に移植し、[131-I]SGMIBラベルしたNZ-1抗体を静脈内投与した。その結果、NZ-1抗体は正常組織にはほとんど滞留せず、グリオブラストーマに効率良く分布した。
これらの結果を総合すると、NZ-1抗体は高い親和性を持ち、効率良く細胞内に取り込まれ、しかも生体内でも効率良く腫瘍に集積することがわかった。現在、毒素型NZ-1抗体の前臨床試験が行われており、臨床応用が期待されている。(Kato et al, NMB, 2010)
これまで概説した通り、ポドプラニンは、悪性脳腫瘍、中皮腫、各種扁平上皮癌に高発現し、がん細胞の浸潤能や転移能を亢進する。一方、ラット抗ヒトポドプラニン抗体NZ-1は、ポドプラニンによる血小板凝集や実験的転移を抑制する。ヒトキメラ型抗ポドプラニン抗体が、ポドプラニン発現細胞の転移抑制効果があるかどうかを調べ、その作用機序を検討した。
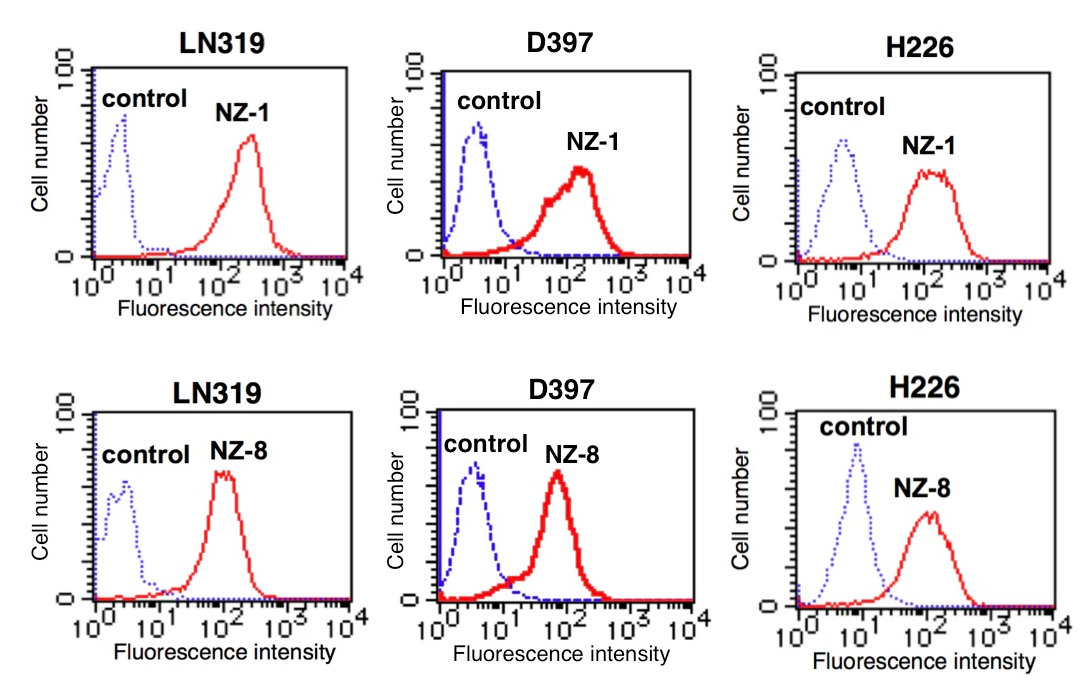
まず、ヒトキメラ型抗ポドプラニン抗体(NZ-8)を作製し、各種がん細胞株に対する反応性を、Flow cytometry法やWestern-blot法により確認した。下の図に示す通り、NZ-8もNZ-1同様に高い反応性を示した。NZ-8はポドプラニンによる血小板凝集を抑制し、転移も有意に抑制した。
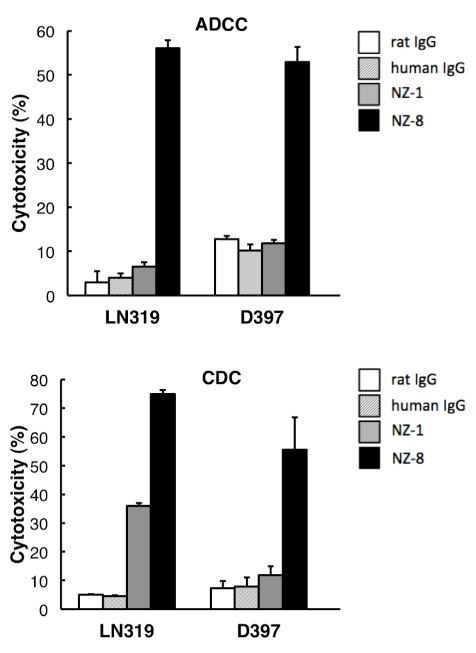
また、抗ポドプラニン抗体の抗体依存性細胞障害活性(ADCC)、補体依存性細胞障害活性(CDC)を検討した。その結果、NZ-1と比較して、NZ-8はポドプラニン発現株に対し高いADCC活性、CDC活性を示した。
一方、NZ-8はin vivoでのポドプラニン発現株の増殖を有意に抑制した。
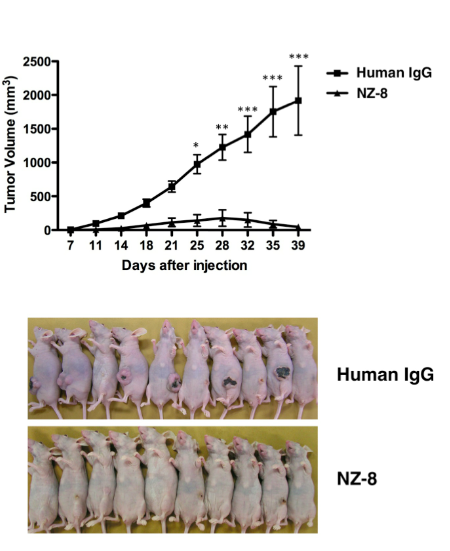
上の結果より、ヒトキメラ型抗ポドプラニン抗体は、血小板凝集阻害活性だけでなく、腫瘍細胞に対して高いエフェクター活性を示すことにより、がん転移を抑制することが示唆された。一方、一般的に転移をおこさない悪性脳腫瘍や悪性中皮腫に対する抗体医薬として、NZ-8が有用である可能性も示された。
1.Tsuruo, T., Yamori, T., Naganuma, K., Tsukagoshi, S., & Sakurai, Y. (1983) Cancer Res. 43, 5437-5442
2.Watanabe, M., Okochi, E., Sugimoto, Y., & Tsuruo, T. (1988) Cancer Res. 48, 6411-6416
3.Sugimoto, Y., Watanabe, M., Oh-hara, T., Sato, S., Isoe, T., & Tsuruo, T. (1991) Cancer Res. 51, 921-925
4.Toyoshima, M., Nakajima, M., Yamori, T., & Tsuruo, T. (1995) Cancer Res. 55, 767-773
5.Kato, Y., Fujita, N., Kunita, A., Sato, S., Kaneko, M., Osawa, M., & Tsuruo, T. (2003) J. Biol. Chem. 278, 51599-51605
6.Williams, M. C., Cao, Y., Hinds, A., Rishi, A. K., & Wetterwald, A. (1996) Am. J. Respir. Cell Mol. Biol. 14, 577-585
7.Breiteneder-Geleff, S., Matsui, K., Soleiman, A., Meraner, P., Poczewski, H., Kalt, R., Schaffner, G., & Kerjaschki, D. (1997) Am. J. Pathol. 151, 1141-1152
8.Ramirez, M. I., Millien, G., Hinds, A., Cao, Y., Seldin, D. C., & Williams, M. C. (2003) Dev. Biol. 256, 61-72
9.Schacht, V., Ramirez, M. I., Hong, Y. K., Hirakawa, S., Feng, D., Harvey, N., Williams, M., Dvorak, A. M., Dvorak, H. F., Oliver, G., & Detmar, M. (2003) EMBO J. 22, 3546-3556.
10.最新の参考文献(Ref)